Science 子刊:揭秘新的长效镇痛钠通道蛋白
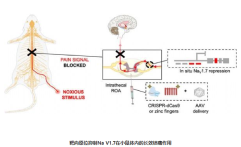
尽管存在大量的副作用和成瘾的风险,但目前对慢性疼痛的治疗仍主要依赖阿片类药物。遗传研究已确定了对伤害感受过程至关重要的人类关键靶标。尤其是Na V 1.7(一种与伤害性感觉传入中的信号传导相关的钠通道蛋白)的遗传性功能丧失突变导致对疼痛不敏感,而没有其他神经发育改变。然而,Na V亚型之间的高序列和结构相似性阻碍了开发选择性抑制剂的努力。
基于此,来自加利福尼亚大学圣地亚哥分校生物工程系的Tony L Yaksh教授,带领团队通过定向体内表观遗传抑制Na V 1.7(LATER)以抑制Na V 1.7,开发了一种使用CRISPR-dCas9和锌指的表观遗传策略,称为长效镇痛。在体内,LATER减少了多种动物模型的痛觉过敏,并逆转了化学疗法诱发的小鼠慢性疼痛。结果表明,LATER可能有效治疗多种原因的慢性疼痛。相关研究成果以“Long-lasting analgesia via targeted in situ repression of NaV1.7 in mice”为题,在线发表在《Science Translational Medicine》杂志上。

研究人员调查了Na V的靶向表观遗传抑制通过表观基因组工程方法,基于簇状规则间隔的回文短回文重复序列(CRISPR)-dCas9和脊髓水平的锌指蛋白在初次传入中获得Na V 1.7的水平,可作为慢性疼痛的潜在治疗方法。接下来,研究人员首先优化了Neuro2A细胞在体外抑制Na V 1.7的效率,然后通过腰椎鞘内途径通过腺相关病毒(AAV)提供了两个表观基因组工程平台,以评估它们在三种小鼠模型中的作用。
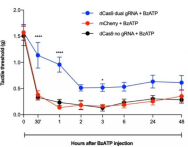
接下来,研究人员探究了在三种常见疼痛模型中两种抑制NaV1.7表达方法的表现。第一种是卡拉胶引起的炎症性疼痛;第二种是紫杉醇引起的神经性疼痛;第三种是BzATP(ATP类似物)引起的疼痛。该研究团队的结果表明有效抑制Na V1.7在腰背根神经节中,炎性状态下的热痛觉过敏减少,神经性状态下的触觉异常性疼痛减少,小鼠的正常运动功能没有改变。

综上所述,这种疗法在不关闭其他钠通道的情况下敲低了Nav1.7的表达,小鼠除了感受不到疼痛外并没有失去任何感觉,也没有表现出其他副作用,这是研究慢性疼痛中又一突破性的治疗方法。
来源:生物谷

