短肽分子手性可控组装方面获进展
发布日期:2021/1/8 9:36:00
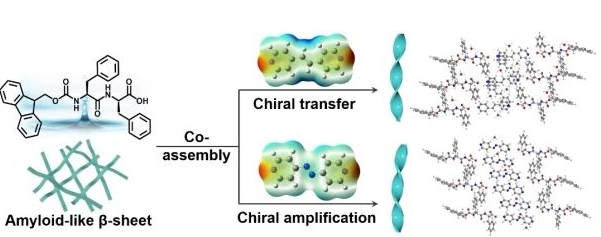
β-淀粉样蛋白多肽的核心识别序列—苯丙氨酸二肽不仅具有超强的自组装能力、易于化学修饰和生物降解等优点,还具有天然的手性特征。以苯丙氨酸二肽作为模仿生物体手性组装的简易模型,对于理解Aβ纤维的结构基础、构建超分子手性材料具有重要意义。
中国科学院化学研究所胶体、界面与化学热力学院重点实验室李峻柏研究团队在短肽分子的可控组装与功能化调控方面取得了一系列重要成果。
近期,该团队将芴基保护的L型苯丙氨酸二肽(L-FmocFF)分别与两种非手性吡啶衍生物进行共组装,制备得到的超分子凝胶组装体由具有淀粉样蛋白特性的β折叠结构转变为具有不同手性的超分子螺旋结构,并出现了鲜有的反超分子手性现象。通过分析凝胶形成的动力学过程以及分子间的相互作用,发现两种非手性分子不同的π-π堆积方式及在水中的聚集能力影响了手性碳在水中的微环境,诱导L-FmocFF发生选择性的手性转移或放大,从而实现了苯丙氨酸二肽类超分子凝胶的手性可控。
相关研究成果发表在Angew. Chem. Int. Ed.上。上述工作获得国家自然科学基金委和中科院的支持。(生物谷Bioon.com)

